In unserem letzten Blog zum Thema Endotoxine ging es um die Bedeutung der Endotoxine im allgemeinen. Im heutigen Blog stellen wir Ihnen den Aufbau einen der am besten untersuchten Vertreter der Endotoxine – das Lipopolysaccharid (LPS) – genauer vor.
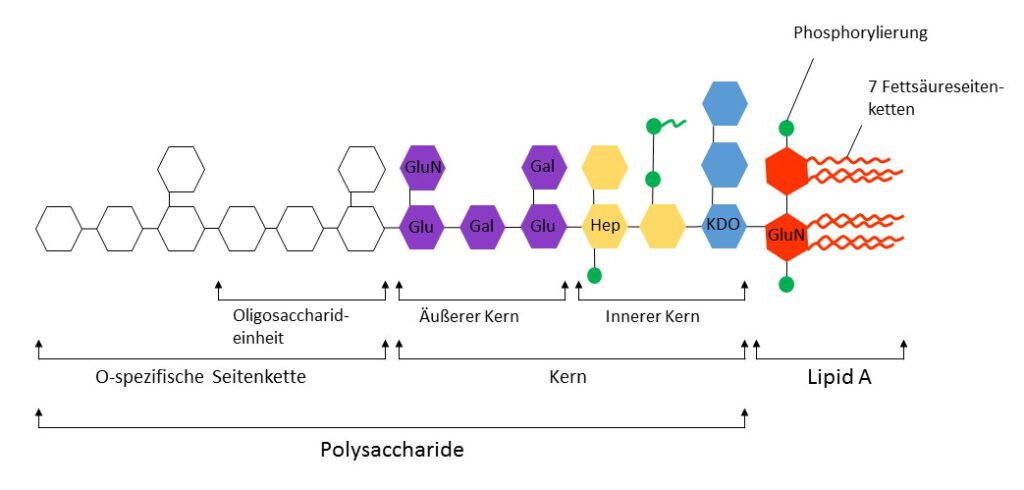
LPS kommt nur in der äußeren Zellwand von Gram-negativen, nicht jedoch von Gram-positiven Bakterien vor. Es trägt zur strukturellen Integrität der Bakterien bei und vermittelt eine Schutzwirkung gegenüber Salzen und lipophilen Antibiotika.1 Molekular besteht LPS aus dem hydrophobem stark konservierten Lipid A, sowie den hydrophilen Komponenten Kernpolysaccharid (Kern) sowie der stark variablen O-spezifischen Polysaccharidseitenkette (Abbildung 1). In den meisten Fällen besteht die O-spezifische Seitenkette aus repetitiven Oligosaccharideinheiten, die zu einer stammspezifischen strukturellen Diversität führen. Der jeweilige Stammspezifische O-Serotyp wird durch die Zusammensetzung und Verkettung der Oligosaccharideinheiten bestimmt. Auf diese Weise stellt der O-Serotyp z.B. das Hauptkriterium für die Serotyp abhängige Klassifizierung von Salmonella dar. Evolutionär haben sich die verschiedenen O-Serotypen der Enterobacteriaceae vermutlich entwickelt, um dem Immunsystem des Wirts durch Variation der Oberflächenstruktur zu entkommen. Durch die Präsentation auf der Oberfläche der Bakterien wirkt LPS als Antigen und wird auch als O-Antigen bezeichnet.2 Bakterien mit gemeinsamen Serotypen (z.B. Gruppe O: Gruppe H: LPS) führen zur gleichen Antikörperantwort.
Abbildung 1. Allgemeiner Aufbau von LPS. Der stark konservierte Lipid A – Bereich besteht aus 7 Fettsäureseitenketten, 2 GluN = N-Acetylglukosaminresten und 2 Modifikationen (i.d.R. Phosphorylierungen, dies kann je nach Stamm und Wachstumsbedingungen variieren). Die Fettsäureketten können je nach Stamm und Wachstumsbedingungen leicht in Länge und Zusammensetzung variieren (meist Capron-, Laurin-, Myristin-, Palmitin- oder Stearinsäure). Der Kernbereich (Kern) besteht aus 1-4 KDO, GluN, Hep = Heptose (am häufigsten L-Glycero-α-D-manno-heptopyranose), Glu = Glukose und Gal = Galaktose und kann je nach Spezies in Zuckeranzahl und Modifikation (am häufigsten Pyrophosphat oder 2‑Aminoethylphosphat) leicht variieren. In den meisten Wildtypen ist auch der innere Kern insbesondere der KDO = 2-Keto-3-desoxy-octonat – Bereich relativ stark konserviert. Die O-spezifische Seitenkette ist relativ variabel und besteht aus Spezies- und Stammspezifischen repetitiven Oligosaccharideinheiten (Hexosen: Rhamnose, Galaktose, Glukose, Mannose sowie einem oder mehreren Didesoxyzuckern wie Abequose, Colitose, Paratose oder Tyvelose), wobei die einzelnen Zucker zum Teil modifiziert sein können. Adaptiert nach Silverman and Ostro, 1998.
Es handelt sich um eine immunologische Klassifizierung, die spezifiziert welcher Antikörper welchen Stamm erkennt. Unterschiedliche Stämme können hierbei gemeinsame Antigene aufweisen und vom gleichen Antikörper erkannt werden. Ein für die Analytik wichtiger Serotyp ist der Escherichia coli Serotyp O113:H10:K–, dessen Endotoxin für die Entwicklung des internationalen Endotoxinstandard verwendet wurde.3
In Wildtypstämmen tritt eine ganze Bandbreite von LPS Molekülen unterschiedlicher Länge auf, ein Effekt, der auf der schrittweisen Synthese der Polysaccharidseitenkette beruht.4 Es ist außerdem möglich im Labor Stämme mit Mutationen in der LPS Synthese zu erzeugen, dies führt je nach Mutation zu unterschiedlichen LPS Varianten, welche in der Natur nicht vorkommen. Ra, Rb, Rc, Rd and Re sind Bezeichnungen für unterschiedlich lange Polysaccharidketten (Abbildung 2). Ra und Re sind die beiden extremsten Varianten, wobei Ra die längste Polysaccharidseitenkette (ohne O-spezifischen Teil) bezeichnet, während Re Varianten nur aus Lipid A und 3 Einheiten KDO bestehen.5 Lipid A wird durch Hydrolyse von LPS aus Re-Stämmen gewonnen, da die Hydrolyse mit zunehmender Polysaccharidseitenkettenlänge komplexer wird. Durch Hydrolyse der Seitenkette können die diphosphorylierte (toxische) bzw. die monophosphorylierte (nicht-toxische) Variante von Lipid A gewonnen werden.6–8 Entfernt man die Fettsäureketten von Lipid A führt dies ebenfalls zum Verlust der Toxizität.9
Abbildung 2. LPS Mutanten und Variabilität. Je näher eine Struktur am Lipid A liegt, desto höher ist ihr konservierungsgrad (bzw. umso niedriger die Variabilität zwischen unterschiedlichen Stämmen). Raue (Rough) Stämme sind im Labor erzeugte Mutanten und kommen natürlich nicht vor. Die Bezeichnung Glatt (Smooth), bzw. Rau (Rough) stammt von der entsprechenden Koloniemorphologie bei Wachstum auf geeignetem festen Nährmedium. Ra-Varianten sind am längsten während Re-Varianten das kürzeste LPS aufweisen. Adaptiert nach Silverman and Ostro, 1998.
Literatur
1. Bacterial endotoxic lipopolysaccharides. (CRC Press, 1992).
2. Methods in microbiology: D. W. Ribbons. Vol. 18: […]. (Academic Press, 1985).
3. 10-178.pdf. at <http://www.nibsc.org/documents/ifu/10-178.pdf>
5. Raetz, C. R. Biochemistry of endotoxins. Annu. Rev. Biochem. 59, 129–170 (1990).